Bienvenue sur MédiPubli, le site qui vous permet d'accéder au rapport annuel médical de la Société Française d'Oto-Rhino-Laryngologie (SFORL) de manière dématérialisée. Santor Edition, une entreprise spécialisée dans les contenus médicaux en ligne, propose la consultation du rapport médical 2023 de la SFORL directement depuis notre plateforme web. Ce rapport est une référence pour les professionnels de santé spécialisés en Oto-Rhino-Laryngologie.
Vous pouvez acheter des articles individuels, des chapitres ou le rapport complet. Vous pouvez accéder en ligne à la version multimédia de vos achats. Et vous pouvez aussi annoter et télécharger les articles achetés. Si vous achetez le rapport complet, vous aurez également accès à la consultation en mode flipbook.
| Prix | Exemple | |
|---|---|---|
| Un article | 5,00 € par article | |
| Un chapitre | 5% de remise sur le prix de l'ensemble des articles | Ex : un chapitre contient 5 articles à 5 €, le prix sera de 25 € - 1,25 € = 23,75 € |
| Un rapport | 25% de remise sur le prix de l'ensemble des articles | Ex : un rapport contient 50 articles à 5 €, le prix sera de 250 € - 62,5 € = 187,5 € |
Chez MédiPubli, nous mettons tout en oeuvre pour que vous puissiez accéder à vos achats de manière simple et pratique sur notre plateforme en ligne. Vous pouvez profiter de toutes les fonctionnalités pour une lecture optimale et nous sommes disponibles pour répondre à toutes vos questions. N'hésitez pas à nous contacter à l'adresse suivante : info@santor.net
Si vous êtes membre de la SFORL, veuillez vous connecter à partir de votre espace membre pour accéder au rapport.
Pr Patrice Tran Ba Huy, Président honoraire de l'Académie nationale de médecine

Préface
Roger Jankowski
1. Introduction
Roger Jankowski

2. Concept évo-dévo des trois nez
2.1. L’ethmoïde est l’os de la base du crâne abritant la muqueuse olfactive
2.2. Le nez respiratoire est d’origine buccale
2.3. Les sinus paranasaux produisent du monoxyde d’azote (NO)
Roger Jankowski

3. Anatomie naso-sinusienne dans le concept évo-dévo
3.1. Anatomie évo-dévo du nez olfactif
3.2. Anatomie évo-dévo du nez respiratoire
3.3. Anatomie évo-dévo du nez sinusien
Sophie Bartier, André Coste, Ludovic De Gabory, Marie Gavid, Roger Jankowski, Basile Landis, Geoffrey Mortuaire, Cécile Rumeau, Clair Vandersteen

4.1.1. Muqueuse et mucus olfactifs
La surface olfactive qui contient les neurones olfactifs primaires (NOP) représente une petite zone de la muqueuse de la cavité nasale, située chez l’Homme dans la partie supérieure des fosses nasales. Contenant les seuls neurones présents à la surface du corps et en contact direct avec le milieu extérieur, la muqueuse olfactive a été considérée et appelée par certains auteurs "une fenêtre vers le cerveau" ("window to the brain") [1]. Cependant, sa répartition topographique exacte dans les fosses nasales reste assez spéculative, la réalisation et l’interprétation des biopsies étant très aléatoires : les études de la littérature montrent que des biopsies réalisées au niveau de la zone supposée olfactive chez le sujet humain adulte, ne retrouvent du tissu olfactif dans moins de 50% des cas [2].

4.1.2. Mécanismes de l’olfaction

4.2. Les transferts aériens lors de la respiration
Chez l’adulte, l’anatomie du nez respiratoire permet de délivrer un débit moyen de 200 à 250 mL/s/fosse nasale soit 10 à 15 L/min au repos et jusqu’à 40 à 45 L/min pour un effort physique modeste. Le cycle respiratoire de repos dure environ 4 secondes (Figure 1). Le flux est instationnaire. Le régime d’écoulement est hétérogène, plutôt laminaire en début et fin d’inspiration et d’expiration, plutôt turbulent dans la majeure partie du cycle. Les résistances nasales à l’écoulement sont entre 0,8 et 2 cm H2O/ls-1 et le collapsus de la valve nasale survient pour une valeur de dépression d’environ 8 cm H2O/ls-1. Il provoque le passage à un régime de respiration buccale.

4.3. L’appareil muco-ciliaire

4.4. L’appareil vasculaire

4.5. L’appareil immunitaire

4.6. Fonctions sinusiennes
Voilà une question à laquelle nombre d’anatomistes, physiologistes, Orl ont cherché une réponse. De nombreuses théories développées à ce sujet, dont les plus répétées et enseignées au fil des siècles n’ont en fait comme seule démonstration que l’intime conviction de leurs auteurs. Les sinus ont été longtemps considérés comme des cavités pauci-fonctionnelles, continuum des fosses nasales, les ostiums étant considérées comme des zones de transition fonctionnant à double sens pour permettre drainage et ventilation. Ce n’est que récemment, grâce en particulier aux travaux de Lundberg et al. (1995) [1], que les sinus paranasaux (démonstration aux sinus maxillaires), ont pu être redéfinis dans leur rôle de producteur, et même de réservoirs dynamiques de monoxyde d’azote (NO).
Romain Gillet, Roger Jankowski, Camille Marçon-Mathis, Duc Trung Nguyen

5. Concept de dysfonctionnement nasal chronique
5.1. Définition (Roger Jankowski)
5.2. Mesures de la qualité de vie (Camille Marçon-Mathis, Duc Ttrung Nguyen)
5.3. Trépied diagnostique IES : interrogatoire – scanner – endoscopie (Roger Jankowski, Romain Gillet)
Sophie Bartier, Emilie Bequignon, André Coste, Louis Crampette, Guillaume De Bonnecaze, Ludovic De Gabory, Virginie Escabasse, Valentin Favier, Maxime Fieux, Roger Jankowski, Jean-Baptiste Lecanu, Margaux Legre, Olivier Malard, Justin Michel, Thomas Radulesco, Cécile Rumeau

6.1. Mesures de l’olfaction
La perte d’odorat est fréquente dans la population générale avec une prévalence entre 4 et 10% selon les études [1]. La dysfonction olfactive augmente avec l’âge, 40% après 65 ans et 62,5% après 80 ans. L’exploration des troubles de l'odorat est essentielle pour, d'une part, envisager une étiologie, un traitement quand c’est possible, et fournir, si besoin, une information médicolégale. Les mesures de l’olfaction peuvent être également un outil de suivi de l’efficacité de thérapeutiques telles que les biothérapies ou la chirurgie dans la polypose nasale.

6.2. Mesures de l’obstruction nasale

6.3. Mesure du NO nasal

6.4. Explorations de la fonction muco-ciliaire
La mesure des propriétés rhéologiques fournit des données objectives et quantitatives de la viscoélasticité du mucus nasal (utilisation d’un rhéomètre). La sévérité des symptômes cliniques semble corrélée à l’augmentation de la viscoélasticité, associée à une altération de la clairance muco-ciliaire chez les patients avec rhinosinusites chroniques [2]. Néanmoins, ces techniques sont lourdes et ne peuvent être utilisées en routine clinique.

6.5. Tests cutanés allergologiques
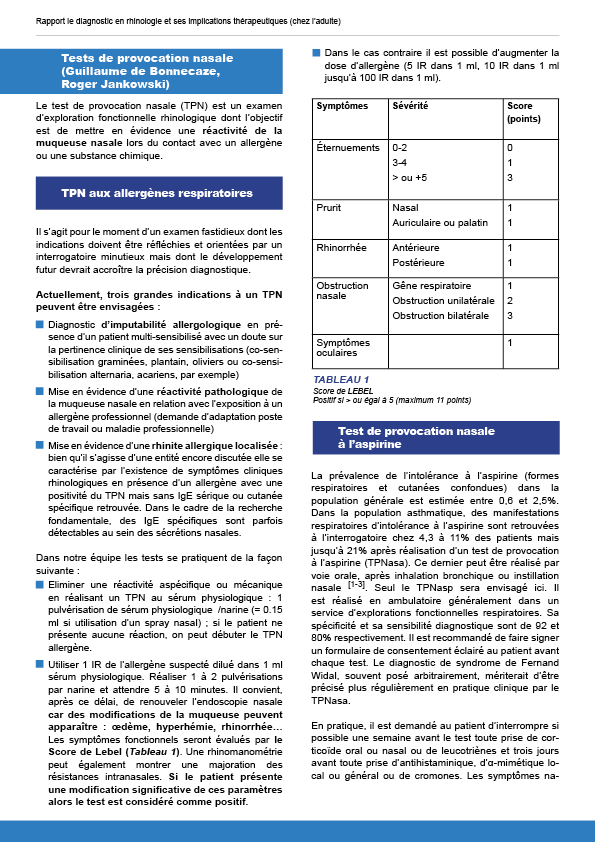
6.6. Tests de provocation nasale
Il s’agit pour le moment d’un examen fastidieux dont les indications doivent être réfléchies et orientées par un interrogatoire minutieux mais dont le développement futur devrait accroître la précision diagnostique.

6.7. Mesure de la β-2 transferrine
La β-2 transferrine est une glycoprotéine retrouvée notamment dans le liquide céphalorachidien (LCR). Sa présence dans les sécrétions nasales, dont elle est naturellement absente, permet de diagnostiquer une rhinorrhée cérébrospinale.
Plusieurs techniques de dosage de la β-2 transferrine existent en fonction des laboratoires : immunofixation, iso électrofocalisation, électrophorèse de zone, ou la combinaison de plusieurs techniques.
Dario Ebode, Caroline Huart, Roger Jankowski, Basile Landis, Geoffrey Mortuaire, Duc Trung Nguyen, Jean-François Papon, Vincent Patron, Philippe Rombeaux, Cécile Rumeau, Clair Vandersteen, Benjamin Verillaud

7.1.1.1. Hypothèse de la muqueuse olfactive vestigiale de l’ethmoïde
La pathogénie de la polypose nasale (PN) est actuellement inconnue. Dans le concept de rhinosinusite chronique (RSC), la PN est une présentation clinique possible des RSC mais les mécanismes à l’origine de l’inflammation chronique supposée des RSC demeurent incompréhensibles : « Research into the aetiology and pathogenesis of chronic rhinosinusitis has been largely irrelevant to the clinician, with minimal impact on management (p.93)» [1]. L’inflammation Th2, initialement décrite comme l’inflammation immunologique prédominante de la réaction allergique [2], peut être retrouvée dans les RSC et en particulier la PN sans être spécifique de celle-ci, conduisant à la recherche d’endotypes pour tenter de rationaliser la prescription des biothérapies sans qu’aucun ne soit actuellement évocateur de la PN [3, 4]. Dans le concept évo-dévo des trois nez, la PN est une maladie inflammatoire spécifique de la muqueuse olfactive vestigiale de l’ethmoïde et l’éradication chirurgicale de celle-ci est un moyen de contrôle efficace de la PN [5-7].

7.1.1.2. Hypothèse de l'inflammation Th2
Les mécanismes de l’inflammation chronique dans la polypose nasale sont comparables à ceux observés dans l’asthme. Ils sont liés à la mise en jeu des cellules de l’immunité adaptative (lymphocytes (Ly) T et B) dont l’activation contribue aussi au recrutement des cellules de l’immunité innée (polynucléaires éosinophiles et basophiles, mastocytes, cellules lymphoïdes innées) par la production de cytokines pro-inflammatoires, d’agents chimiotactiques et d’immunoglobulines (Igs). Le dialogue permanent entre ces différents acteurs concourt à l’entretien de la réaction inflammatoire locale marquée par la vasodilatation, l’œdème sous-muqueux, l’hypersécrétion muqueuse et le remodelage épithélial (métaplasie, lyse épithéliale, épaississement de la membrane basale) à l’origine de la formation des polypes [1] (Figure 1).

7.1.2. Tableaux cliniques

7.1.3. Diagnostics différentiels

7.1.4.1. Médicaux

7.1.4.2. Chirurgicaux
L’ethmoïde est anatomiquement un sinus paranasal c'est-à-dire une cavité aérienne tapissée par la même muqueuse que les fosses nasales [1] et physiologiquement une cavité multi-cloisonnée saine à condition que les cellules ethmoïdales des masses latérales restent ventilées et drainées [2]. Le défaut de ventilation ou drainage des sinus maxillaire et frontal, dont l’ostium s’abouche dans l’ethmoïde antérieur, est conditionné par la pathologie homolatérale du complexe ostio-méatal [3], c'est-à-dire des cellules ethmoïdales du méat moyen autour de la gouttière unci-bullaire; le défaut de ventilation ou drainage du sinus sphénoïdal, dont l’ostium s’ouvre dans la fente olfactive postérieure ou le récessus sphéno-ethmoïdal, peut être conditionné par la pathologie des cellules ethmoïdales postérieures. L’obstruction ostiale apparaît comme une conséquence de l’inflammation princeps de la muqueuse rhinosinusienne, qui peut être d’origine extrinsèque (pollution, infections virales ou bactériennes, tabagisme, etc.) ou intrinsèque (allergie, déficit immunitaire, maladie génétique telle la mucoviscidose, etc.) [4], et de facteurs anatomiques locaux (concha bullosa, inversion de courbure du cornet moyen, anomalies d’insertion ou de forme de l’unciforme, etc.). L’obstruction ostiale aggravée par la rétention des sécrétions et le défaut d’aération, l’inflammation princeps de la muqueuse et est à l’origine d’un cercle vicieux entretenant la chronicité de l’inflammation muqueuse. La raison pour laquelle certains patients développent des polypes (RSC avec polypes) est inconnue. La chirurgie a pour but dans le concept de RSC de restaurer la ventilation et le drainage des cavités sinusiennes en réséquant à la demande la muqueuse pathologique et les anomalies anatomiques tout en préservant au mieux la muqueuse sinusienne (dans l’ethmoïde y compris) saine ou celle dont l’inflammation paraît pouvoir être réversible. La chirurgie apparaît ainsi le plus souvent comme un complément au traitement médical (dont les récentes biothérapies) et n’est que rarement considérée comme un traitement à part entière [5].
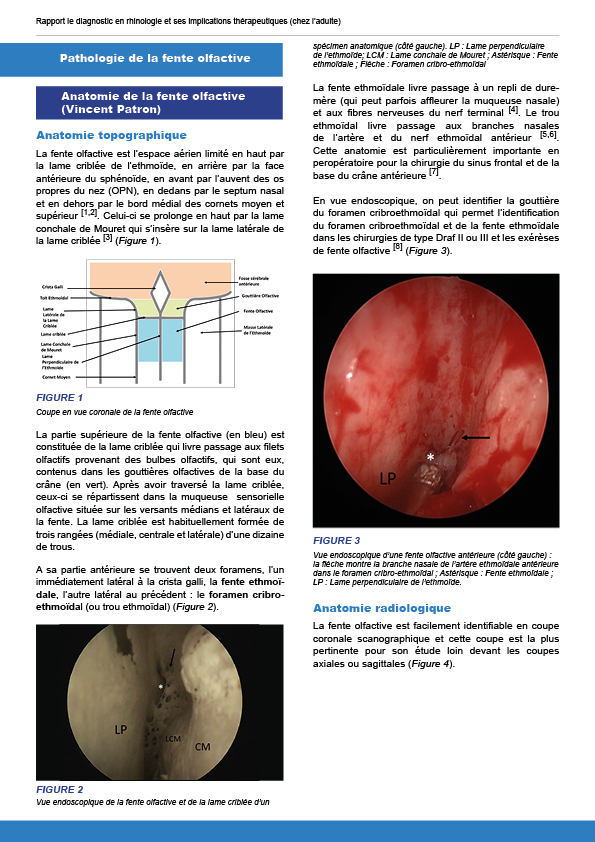
7.2.1. Anatomie de la fente olfactive

7.2.2. Presbyosmies

7.2.3. Hypo-anosmies

7.2.4. Dysosmies
Une dysosmie quantitative est caractérisée par une élévation des seuils de perception des odeurs/flaveurs, ou d’un trouble de la discrimination d’une odeur/flaveur par rapport à une autre, ou de difficultés d’identification des odeurs/flaveurs (reconnaissance du « nom » de l’odeur). Ces trois paramètres sont souvent agrégés dans une échelle quantitative d’évaluation olfactive à 3 paliers à savoir la normosmie (fonction olfactive normale ou subnormale), l’hyposmie (diminution incomplète de la fonction olfactive), et l’anosmie (privation totale ou fonctionnelle de la fonction olfactive). On y adjoint l’hyperosmie, affection rare abaissant les seuils de perception olfactive et rendant le sujet particulièrement sensible à certaines odeurs. Les dysosmies quantitatives sont traitées dans les chapitres précédents (hypoanosmies et presbyosmies).

7.2.5. Fuites cérébro-spinales spontanées : approches diagnostiques et thérapeutiques
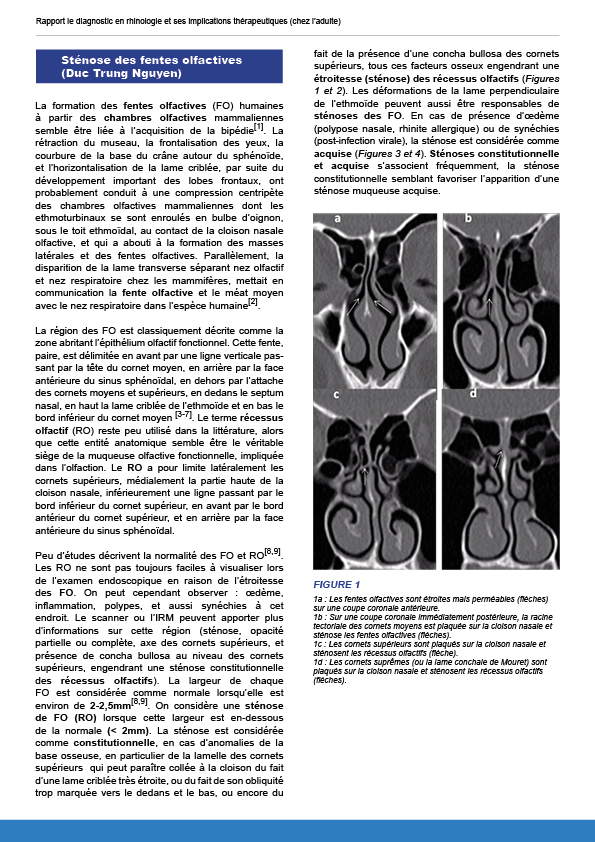
7.2.6. Sténoses des fentes olfactives
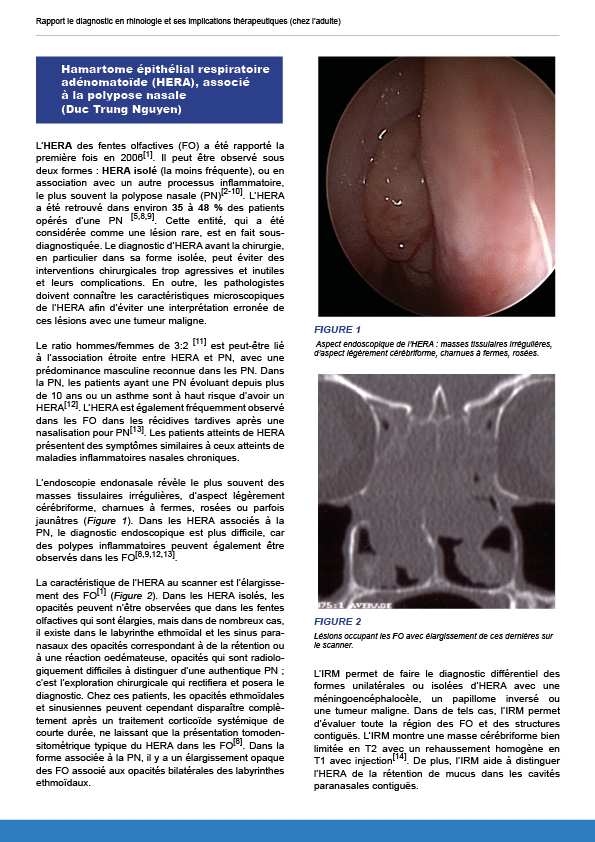
7.2.7. Hamartome épithélial respiratoire adénomatoïde associé à la polypose
Zakaria Arkoubi, Maxime Barron, Louis Crampette, Guillaume De Bonnecaze, Dario Ebode, Leila Essakalli, Valentin Favier, Maxime Fieux, Roger Jankowski, Jean-Baptiste Lecanu, Olivier Malard, Eric Moreddu, Jean-François Papon, Vincent Patron, Cécile Rumeau, Nicolas Saroul, Angelica Tiotiu, Thierry Van Den Abbeele

8.1.1. Hypothèses pathogéniques
Dans l’hypothèse évo-dévo, le nez respiratoire se forme sous le nez olfactif ethmoïdal par remaniement et remodelage des os primitifs du palais secondaire[4] ; chez l’humain bipède, le plancher ethmoïdal (la lame transverse) a disparu, ce qui met en communication les conduits respiratoires avec les fentes olfactives médialement et les méats moyens latéralement qui sont séparés par le bord libre du cornet moyen. Les pneumallergènes et les polluants atmosphériques entrent ainsi en contact avec la muqueuse tapissant les cornets inférieurs, le plancher et la cloison des fosses nasales respiratoires mais peuvent aussi entrer en contact avec la muqueuse transitionnelle du bord libre des cornets moyens, du vestibule des fentes olfactives, ou des méats moyens. Ainsi se trouvent définis les sites anatomiques où peut se développer visiblement une réaction inflammatoire pathologique d’origine intrinsèque (en rapport avec un terrain allergique) ou extrinsèque (en rapport avec une exposition chronique à des substances chimiques).

8.1.2. Tableaux cliniques des Rhinites Respiratoires Chroniques
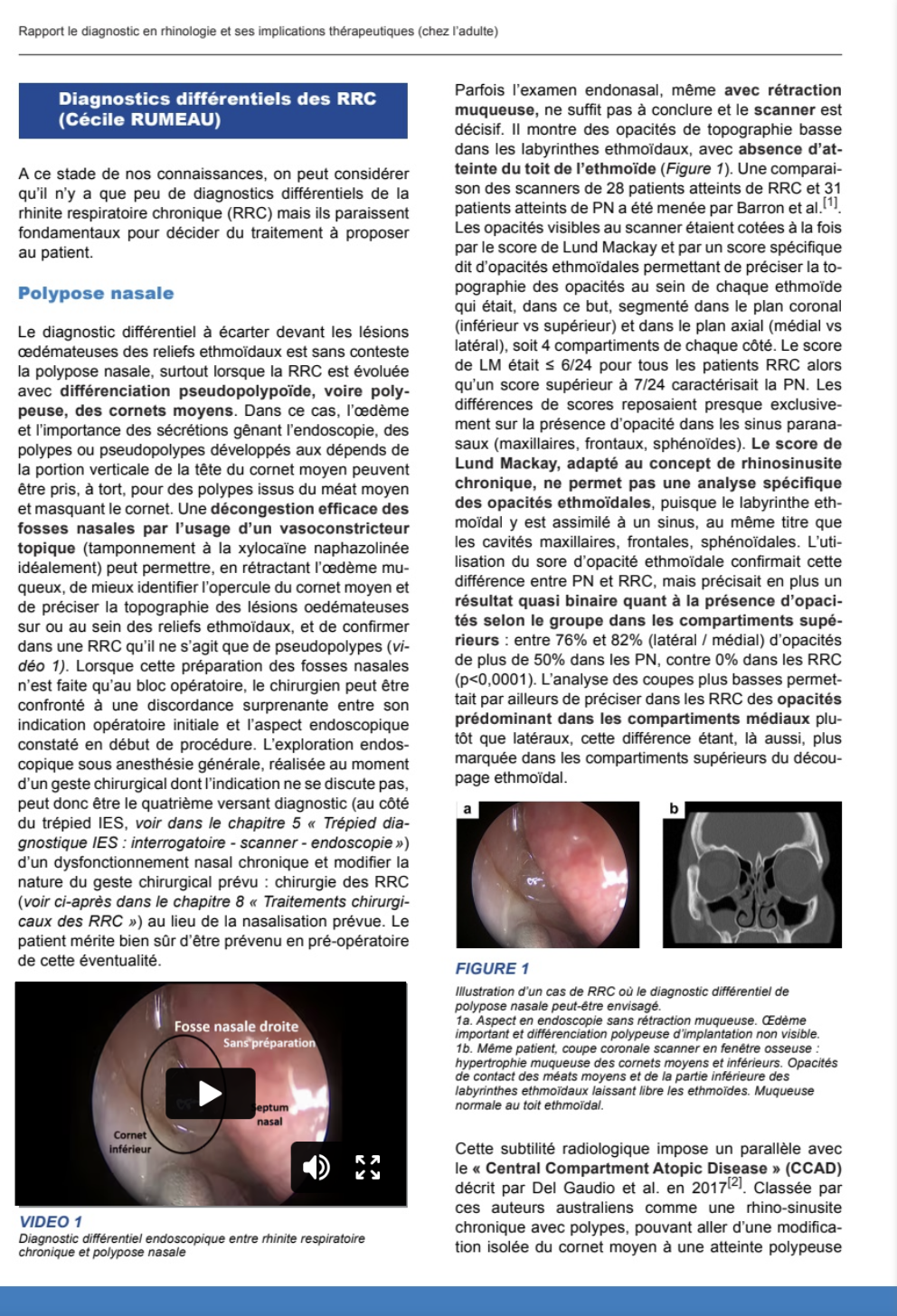
8.1.3. Diagnostics différentiels des Rhinites Respiratoires Chroniques
Le diagnostic différentiel à écarter devant les lésions œdémateuses des reliefs ethmoïdaux est sans conteste la polypose nasale, surtout lorsque la RRC est évoluée avec différenciation pseudopolypoïde, voire polypeuse, des cornets moyens. Dans ce cas, l’œdème et l’importance des sécrétions gênant l’endoscopie, des polypes ou pseudopolypes développés aux dépends de la portion verticale de la tête du cornet moyen peuvent être pris, à tort, pour des polypes issus du méat moyen et masquant le cornet. Une décongestion efficace des fosses nasales par l’usage d’un vasoconstricteur topique (tamponnement à la xylocaïne naphazolinée idéalement) peut permettre, en rétractant l’œdème muqueux, de mieux identifier l’opercule du cornet moyen et de préciser la topographie des lésions oedémateuses sur ou au sein des reliefs ethmoïdaux, et de confirmer dans une RRC qu’il ne s’agit que de pseudopolypes (vidéo 1). Lorsque cette préparation des fosses nasales n’est faite qu’au bloc opératoire, le chirurgien peut être confronté à une discordance surprenante entre son indication opératoire initiale et l’aspect endoscopique constaté en début de procédure. L’exploration endoscopique sous anesthésie générale, réalisée au moment d’un geste chirurgical dont l’indication ne se discute pas, peut donc être le quatrième versant diagnostic (au côté du trépied IES, voir dans le chapitre 5 "Trépied diagnostique IES : interrogatoire – scanner – endoscopie") d’un dysfonctionnement nasal chronique et modifier la nature du geste chirurgical prévu : chirurgie des RRC (voir dans le chapitre 8 "Traitements chirurgicaux des RRC") au lieu de la nasalisation prévue. Le patient mérite bien sûr d’être prévenu en pré-opératoire de cette éventualité.

8.1.4.1. Médicaux
Le traitement le plus efficace de la rhinite allergique reste l’éviction de l’allergène. Malheureusement, à contrario des allergènes alimentaires, il est souvent difficile de ne pas s’exposer aux pneumallergènes. Les seules études disponibles dans la littérature concernent l’éviction des pneumallergènes intérieurs (acariens, poils de chat). L’utilisation d’acaricides couplés à des mesures d’hygiène de la chambre à coucher (lavage régulier des sols, draps et couvertures) semble avoir un effet bénéfique sur les symptômes de RA, alors que l’utilisation seule de literie anti-acarien ne semble pas être suffisante pour obtenir un bénéfice clinique[1]. Concernant les pneumallergènes extérieurs, essentiellement les pollens, il est licite de conseiller aux patients de se débarrasser de leurs vêtements et de prendre une douche incluant le lavage des cheveux à leur arrivée au domicile, afin de diminuer la quantité d’allergènes présents sur eux.

8.1.4.2. Chirurgicaux

8.2.1. Déviations septales obstructives

8.2.2. Dysfonctionnements vasomoteurs intrinsèques (DVI)
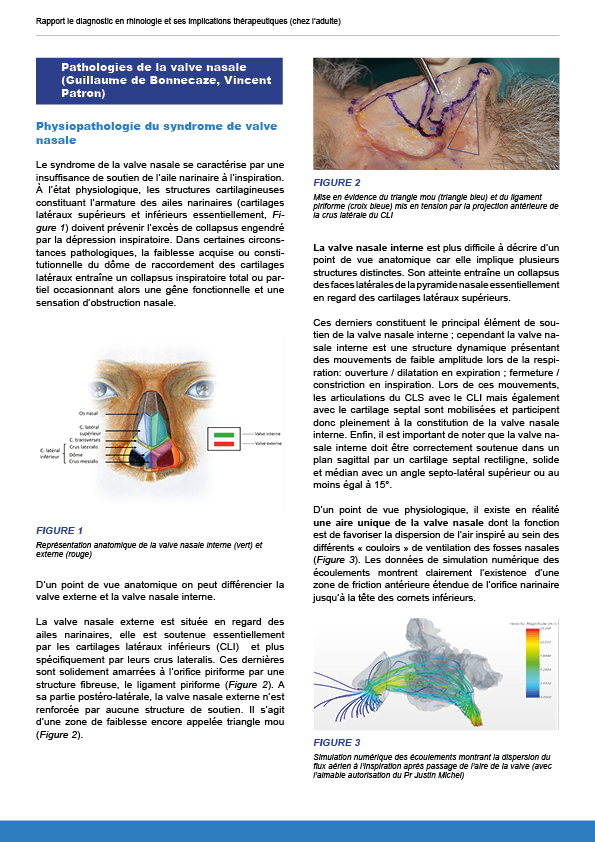
8.2.3. Pathologies de la valve nasale
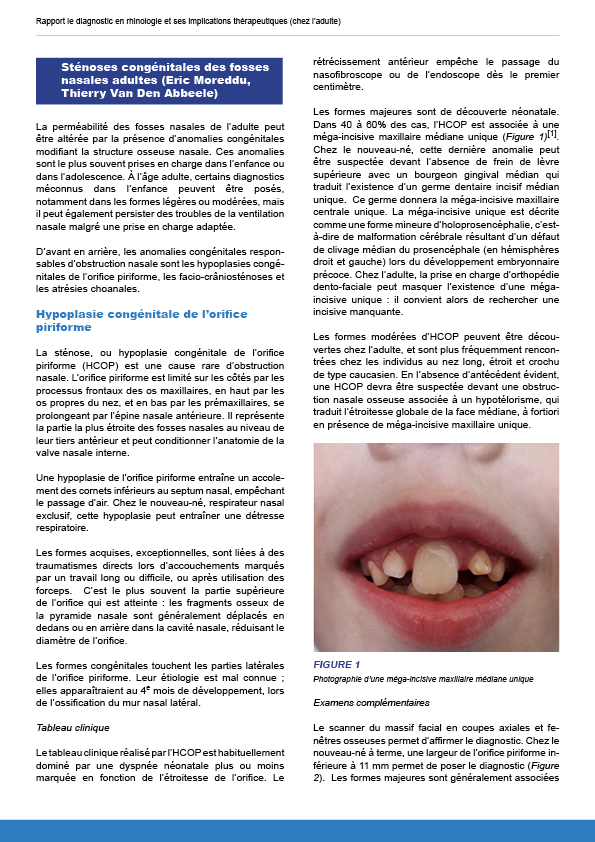
8.2.4. Sténoses congénitales des fosses nasales adultes
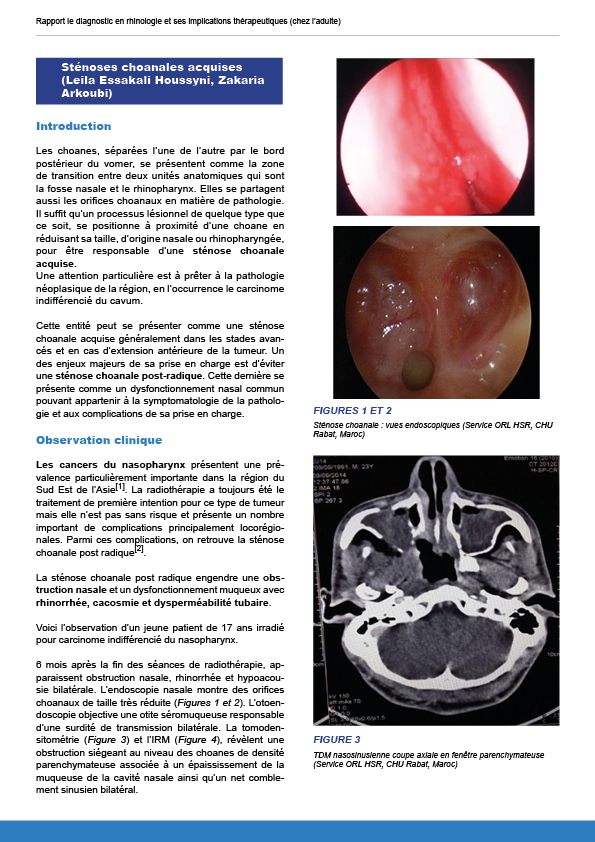
8.2.5. Sténoses choanales acquises

8.3. Rhinites croûteuses

8.4. Epistaxis à répétition
Laurent Castillo, Ludovic De Gabory, Laurent Gilain, Roger Jankowski, Quentin Lisan, Sonia Mirafzal, Cécile Rumeau, Nicolas Saroul, Elie Serrano, Clair Vandersteen, Benjamin Verillaud

9.1. La sinusite chronique (maxillaire ou frontale ou sphénoïdale)
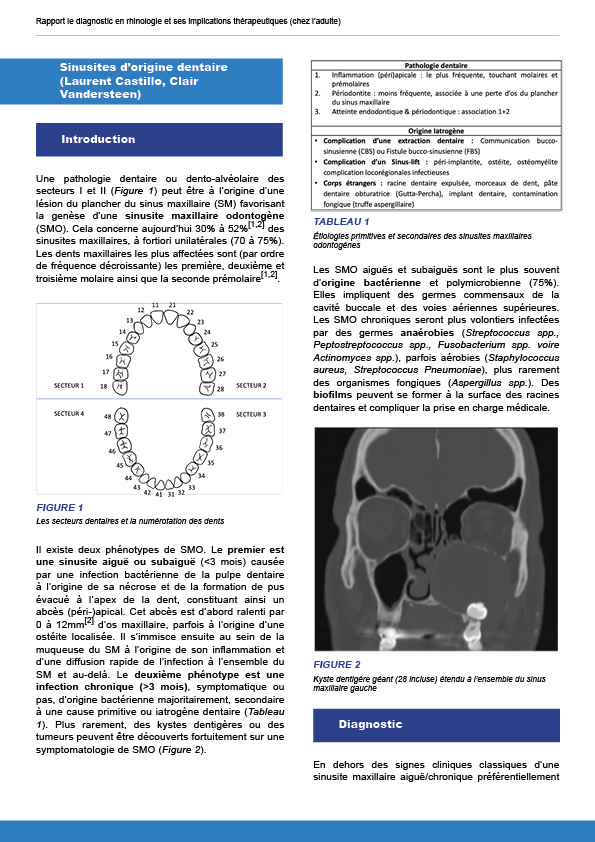
9.2. Sinusites d’origine dentaire

9.3. Mycétomes et corps étrangers sinusiens

9.4. Ostéocondensations des parois sinusiennes
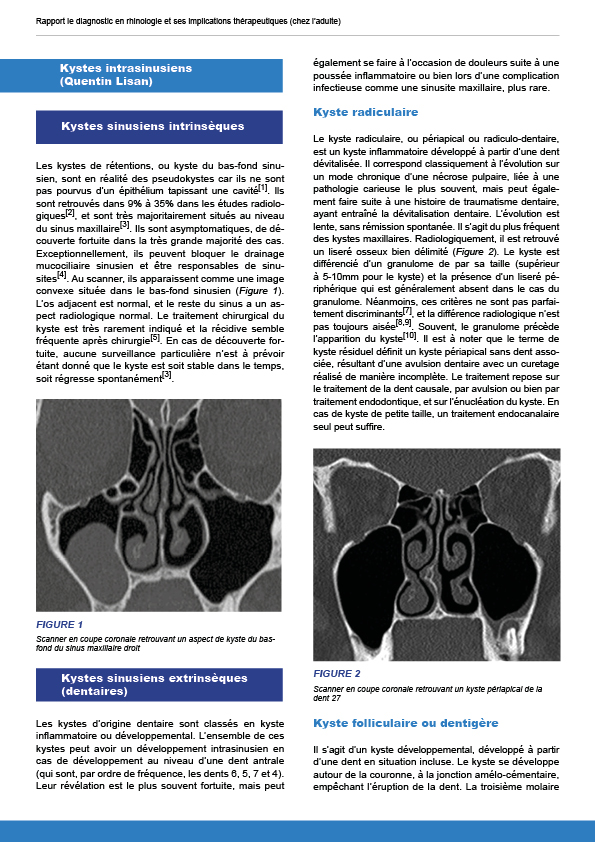
9.5. Kystes intrasinusiens

9.6. Dysperméabilités ostiales

9.7. Arrêts de la pneumatisation sinusienne
Le sinus maxillaire avait été découvert à la suite d’extractions dentaires[2] et le sinus frontal de traumatismes faciaux, bien avant les dissection méthodiques de Zuckerkandl qui mettaient en évidence, en plus des cavités maxillaires et frontales, l’existence de cavités paranasales ethmoïdales de structure complexe et la communication entre elles de toutes ces cavités et avec les fosses nasales. L’hypothèse de la présence de cavités « aériennes » dans le massif facial vivant fut rapidement étayée par la découverte des rayons X par Roentgen en 1895. Son article princeps présentait l’image du squelette d’une main obtenue avec un rayonnement invisible appelés X : la découverte des rayons X et l’invention de la radiologie sont datées du même jour. La raison de l’existence de ces cavités centro-faciales dont on supposait la physiologie reposer sur leur ventilation et drainage par les fosses nasales est restée pareillement inexpliquée : allègement du massif facial ? Isolation thermique des systèmes nerveux central et oculaire ? résonateurs vocaux ?... (voir dans le chapitre 4 « Fonctions sinusiennes »). Leur développement radiologique ne semblait avoir lieu qu’après la naissance mais, sur le plan embryologique[3], l’ébauche des sinus maxillaires et frontaux semblait présente dans le précurseur ethmoïdal. L’hypothèse la plus couramment admise fut longtemps que des « cellules ethmoïdales » spécifiques, colonisaient par leur pouvoir d’expansion au travers d’un petit orifice appelé ostium les os maxillaires, frontaux et sphénoïdaux pour les transformer en de grandes cavités sinusiennes. Mais, aucun pouvoir ostéoclastique de la muqueuse ethmoïdale n’a jamais pu être mis en évidence pour conforter cette hypothèse. Pas plus que la ventilation sinusienne à partir du nez n’a pu être documentée[4].

9.8. Hypoplasies sinusiennes

9.9. Pneumosinus dilatans
Nathalie Benoit-Oker, Emilie Bequignon, André Coste, David Ebbo, Roger Jankowski, Virgine Escabasse, Elie Serrano, Benjamin Verillaud

10.1. Concept de rhinosinusite chronique

10.2. Rhinosinusites chroniques œdémato-purulentes (RSCOP)

10.3. Le syndrome sino-bronchique

10.4. RSC des maladies systémiques

10.5. RSC fongique allergique
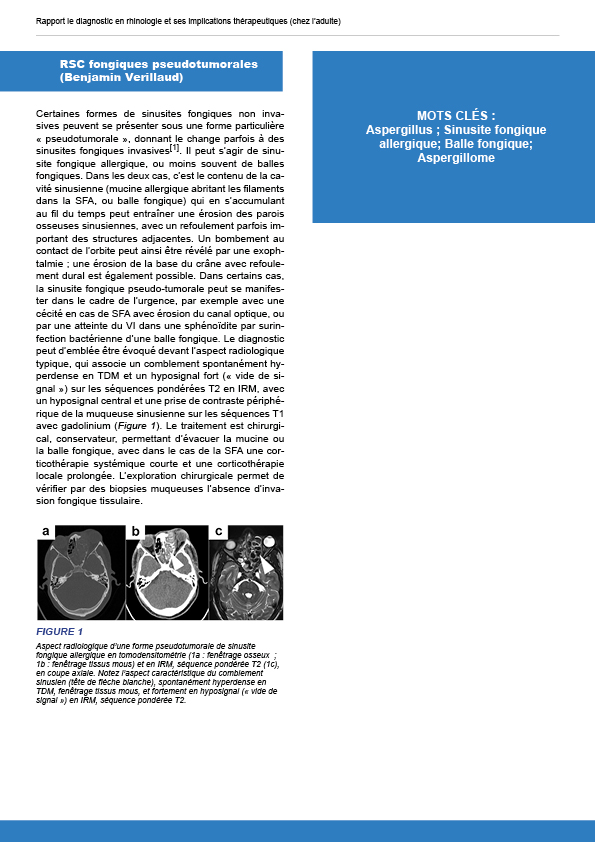
10.6. RSC fongique pseudotumorale
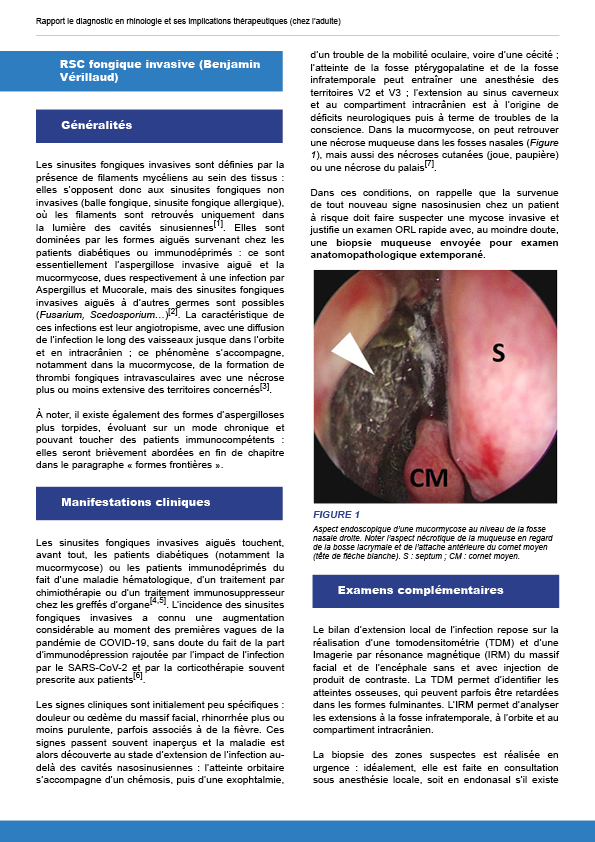
10.7. RSC fongique invasive
Roger Jankowski, Angelica Tiotiu
11.1. Concept évo-dévo d’arbre aérien

11.2. Polypose nasale et otite séromuqueuse

11.3. Relations pathogéniques entre nez respiratoire et arbre trachéo-bronchique et entre nez olfactif et système bronchio-alvéolaire
Imane Azzam, Niema Benkhraba, Laurent Castillo, Ludovic De Gabory, Leila Essakalli, Patrice Gallet, Romain Gillet, Philippe Herman, Roger Jankowski, Duc Trung Nguyen, Vincent Patron, Clair Vandersteen, Sébastien Vergez, Benjamin Verillaud

12.1.1.1. Mucocèles
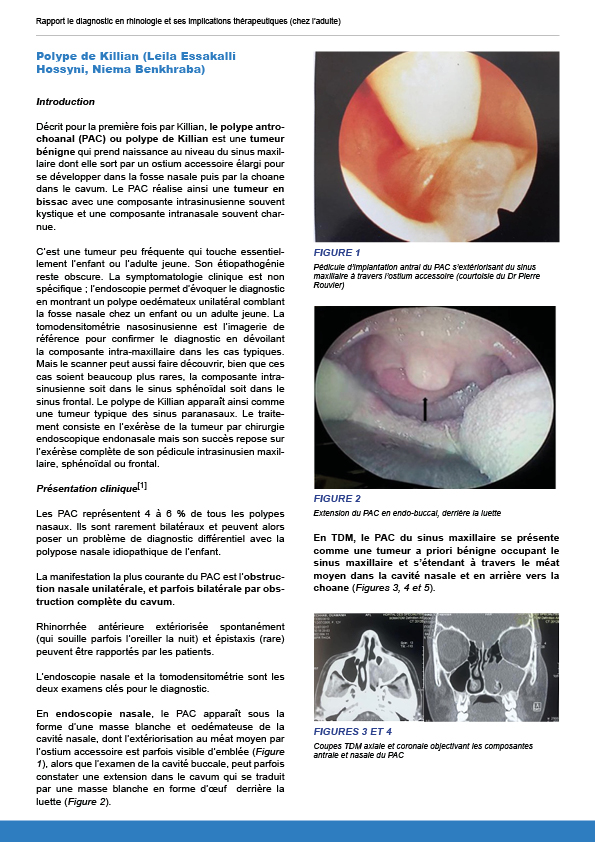
12.1.1.2. Polype de Killian
Décrit pour la première fois par Killian, le polype antrochoanal (PAC) ou polype de Killian est une tumeur bénigne qui prend naissance au niveau du sinus maxillaire dont elle sort par un ostium accessoire élargi pour se développer dans la fosse nasale puis par la choane dans le cavum. Le PAC réalise ainsi une tumeur en bissac avec une composante intrasinusienne souvent kystique et une composante intranasale souvent charnue.

12.1.1.3. Papillome inversé

12.1.1.4. Autres papillomes non inversés
Les papillomes exophytiques surviennent préférentiellement chez les hommes de 30 à 50 ans[1,2]. Cette lésion, macroscopiquement fongiforme et multifocale chez 40% des patients, se localise initialement préférentiellement sur le septum nasal proche de l’orifice narinaire. L’HPV-6 et -11 sont détectés chez 60% des patients. L’imagerie est souvent peu contributive (souvent de petite taille car bien visible). Une résection chirurgicale est recommandée mais une récidive précoce (1/3 des patients après 2 à 6 mois post-opératoire) ou tardive (1/3 des patients) sont possibles. Cette récidive peut survenir jusqu’à 11 ans après leur exérèse[3], imposant une surveillance prolongée. Le risque de dégénérescence est plus rare mais non nul.
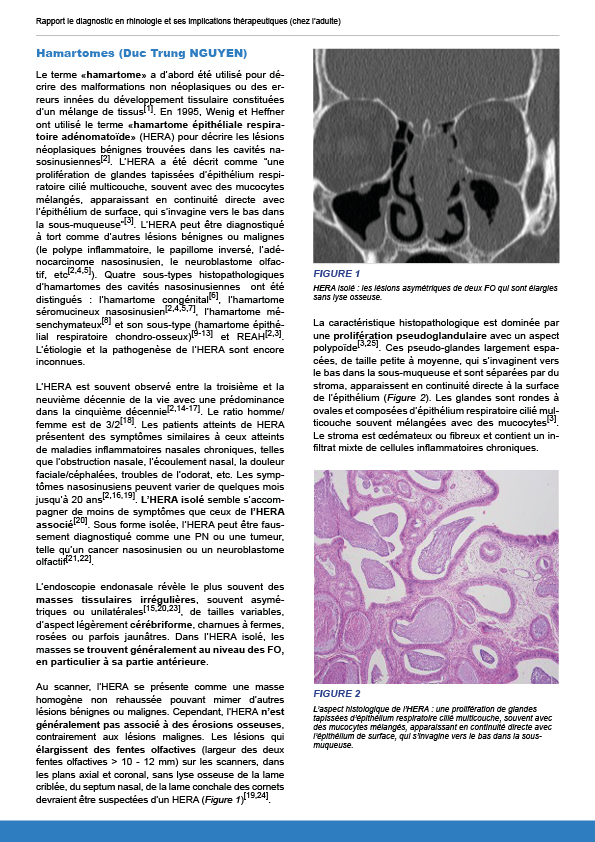
12.1.1.5. Hamartomes
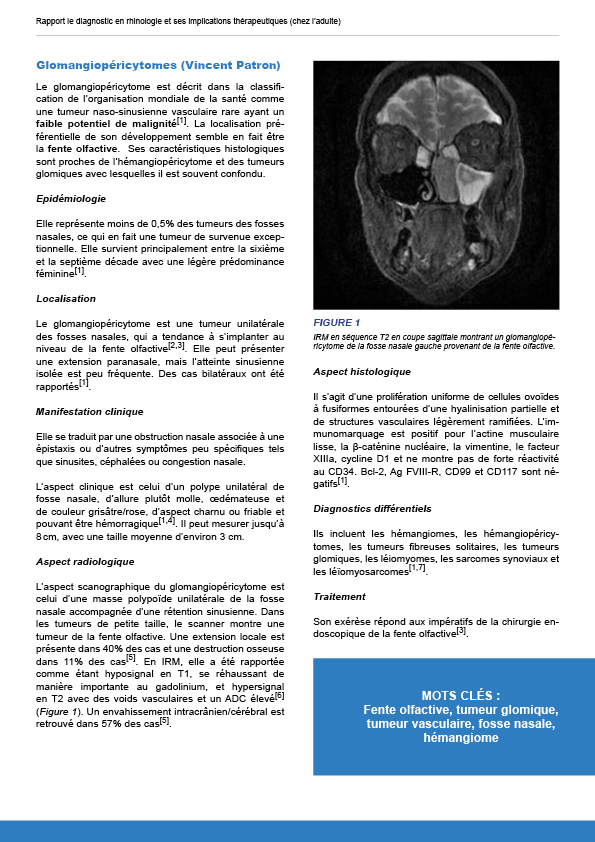
12.1.1.6. Glomangiopéricytome

12.1.1.7. Angiofibrome nasopharyngé

12.1.1.8. Tumeurs osseuses bénignes

12.1.2. Revue critique des tumeurs bénignes dans le concept des trois nez
Ainsi le polype de Killian se développe préférentiellement à partir du sinus maxillaire et la forme antrochoanale, qui est la plus fréquente et le modèle de description, permet d’individualiser et de reconnaître les polypes sphénochoanaux[1] [2] et frontochoanaux[3] beaucoup plus rares mais qui relèvent alors des mêmes principes thérapeutiques : c’est l’exérèse complète du pédicule à l’intérieur de la cavité sinusienne qui est le garant de la guérison[4].

12.2.1.1. Tumeurs malignes muqueuses : Synthèse des recommandations REFCOR
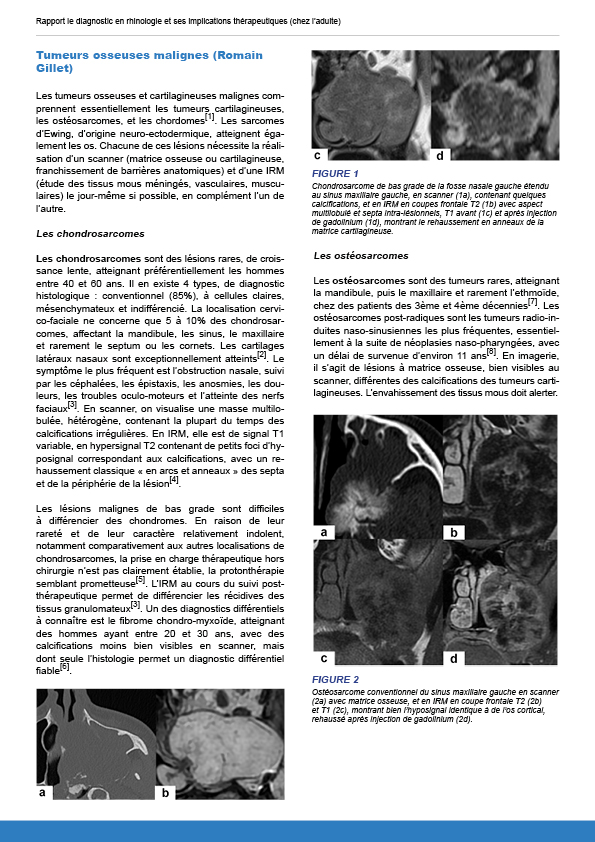
12.2.1.2. Tumeurs malignes osseuses

12.2.2. Revue critique des tumeurs malignes dans le concept des trois nez
Roger Jankowski

13. Conclusion
Rapport 2023
281.25 €
Remise de 25% soit 93.75 €