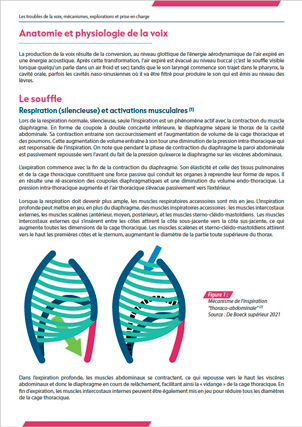
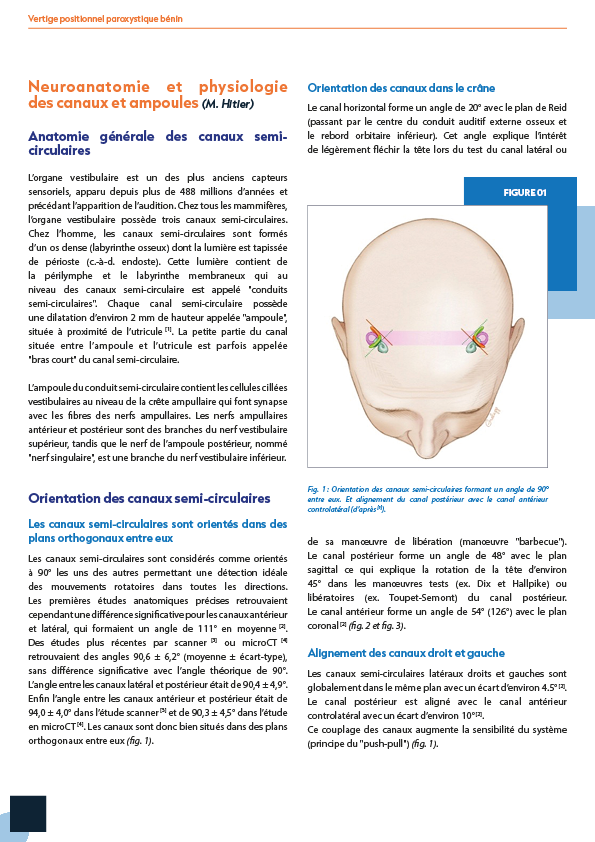
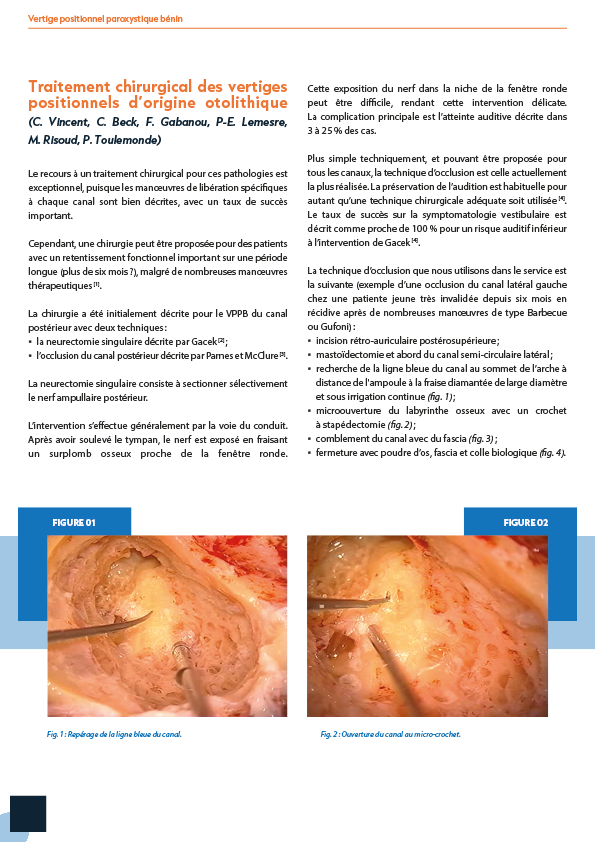
1.1. Définition
Depuis la première description par Bárány, en 1921, puis l’appellation de VPPB proprement dite et sa codification clinique précise par Dix et Hallpike, en 1952, la physiopathologie repose encore essentiellement sur une construction intellectuelle étayée par les principes physiques centrés sur la gravité. L’otolithe semble jouer le rôle principal des perturbations mécaniques induites dans le vestibule. Ainsi, en dépit de modèles expérimentaux plausibles et de modèles mécaniques irréfutables de logique, l’impossibilité, à ce jour, d’observer directement des otolithes dans le système vestibulaire in vivo chez l’homme reste une faiblesse majeure. Si cette limite soulève des incertitudes étiopathogéniques, sur le plan clinique, l’efficacité des approches diagnostiques et thérapeutiques n’est cependant pas altérée. Le diagnostic du VPPB repose sur un socle clinique robuste dans sa forme la plus fréquente, mais demeure un défi clinique dans ses formes atypiques ou résistantes, pouvant requérir une approche pluridisciplinaire.